中国科技网-科技日报记者 刘霞
几乎每个化学实验室的墙上,都有一张元素周期表。通常,我们将元素周期表的创造归功于俄国化学家迪米特里·门捷列夫。1869年,他将当时已知的63种元素写在卡片上,并根据化学和物理性质对它们进行排列,这就是我们现在耳熟能详的元素周期表的雏形。
为庆祝元素周期表诞生150周年,联合国宣布将2019年定为国际化学元素周期表年。150年风雨变迁,物是人非,元素周期表能安然度过下一个150年吗?
随着我们对元素的认知日益深刻,科学家发现了元素周期表不少“怪异”之处,有人怀疑现在的元素周期表是否是最佳排列方式,并提出要对其进行重新设计。英国《新科学家》杂志在近日的报道中,对现有元素周期表的“怪异”之处以及科学家提出的替代方案进行了介绍。
氢应“身居”何处?
让我们先从打头阵的氢开始。氢的最外层电子数为1,排在现在的位置或许也无可厚非——在第1族内,排在最外层同样只有一个电子的锂和钠之后。
然而,氢是气体,不是金属,因此,从属性上来说,有点“德不配位”。
由于氢的外壳只能容纳两个电子,而氢实际上只有一个电子,这使其处于不圆满状态,导致化学活性非常活跃。在这个意义上,氢类似于第17组中的元素——氯等卤族元素。它们的外壳只需要获得一个电子就可完整,这就使氢和卤族元素具有相似的反应活性。因此,就性质而言,氢比锂更接近氯。
汞和金为何如此“怪异”?
此外,在元素周期表下方的汞也很“怪异”。
汞在室温下呈液态。从这个意义上来说,它与第12族的其他成员(包括锌和镉)完全不同,因为后两者都是固体金属。
科学家解释说,在元素周期表中,越往后的元素,其原子核中质子所带正电荷数就越多,对核外电子产生的吸力更大,这意味着它们必须以越来越快的速度运行。根据爱因斯坦的相对论,这会导致它们的实际质量远远大于电子的正常质量,从而增加内向拉力。
而汞电子的运行速度高达光速的58%,这使它们的电子轨道非常紧密,无法与别的原子发生联系,因此无法成为固体。
同样的道理也解释了为什么金是金色——金属中一种独特的颜色:相对论效应改变了电子吸收光的方式。
F区难题
第3族有2个可能属于其他地方的元素。
电子在不同的轨道内,填满整个原子核的外壳,电子每填满一个轨道便进入下一层轨道。当我们沿着周期表往下看,到了第57号元素(镧),电子便开始进入新轨道,即F轨道。为了反映这一点,元素周期表将组成F区的元素单独放在周期表的下方,从而在第3族留下一个缺口。
这容易理解,但科学家对F区中哪个元素应排在最前面仍有争议。一些化学家坚持认为,应按电子的排序来确定顺序,即维持现在的顺序,把镧和锕排在F区最左侧。还有人认为,按化学性质(如原子半径和熔点)来看,把目前排在最右的镥和铹排在最前面更好。
2016年,国际纯化学与应用化学联合会组建了一个工作小组来解决这一争论,但可能很难在短期内给出结论。
替代方案层出不穷
所有这些问题都让一些化学家相信,我们需要重新设计元素周期表的布局,以突出在传统表格中并不明显的元素之间的相关性。
目前并不乏这方面的想法,科学家们已提出了数百个版本的元素周期表(英国曼彻斯特城市大学的马克·里奇保留了这些版本的周期表的互联网数据库),其中西奥多·本菲提出的螺旋状和退休的加拿大化学家费尔南多·杜富尔发明的看似圣诞树的3D版本尤为流行。
其中,螺旋式元素周期表以氢元素为中心,元素随着原子质量增加呈螺旋式上升。每个轮辐(从中心到外围的直线)上的元素具有相同的属性,就像今天元素周期表中同一族的元素一样。
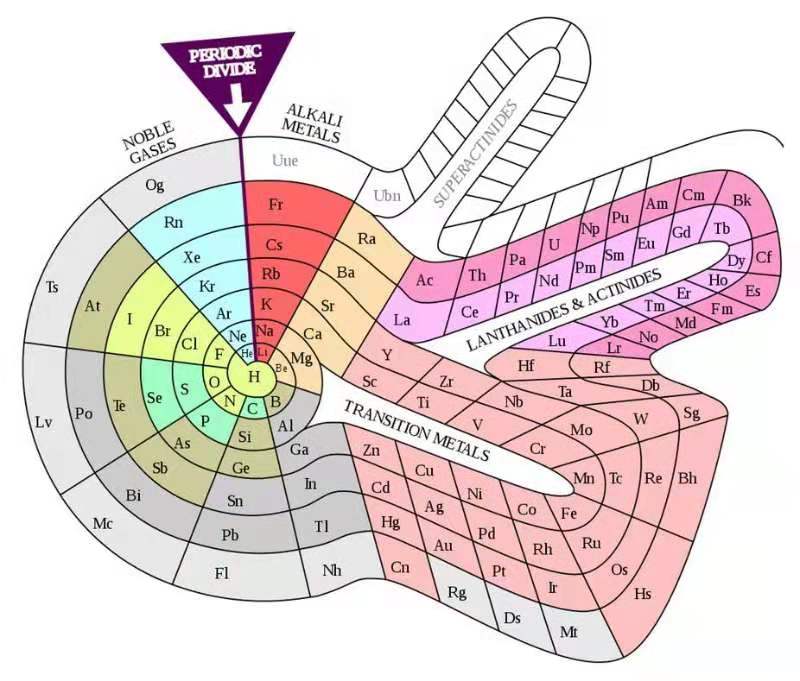
西奥多·本菲提出的螺旋周期表(1964),强调了元素之间的连续性。图片来源:英国《新科学家》网站
美国加州大学洛杉矶分校的埃里克·谢里则支持一种更彻底的修改方法:通过把F区的全部30种元素放进现在的第2和第3族之间,使竖列从18列变为32列。如此一来,周期表中的原子序号就可以连续排列。
但德国马克斯·普朗克数学研究所的吉勒莫·雷斯特雷波倾向于另一种方式。鉴于我们对元素化学反应性的了解不断增加,他研究了同一周期中元素的化学相似性是否与150年前相同。他得出结论称,镧应属于第3族——也就是说,不符合当前顺序。
重新设计元素周期表或许看起来像是唐吉柯德式的探索,但也许很快会成为一项紧迫工作。我们已经开始寻找第119号元素。它在何处?把它安排在元素周期表的什么位置合适?我们只能拭目以待。