科技日报记者 张梦然
最新一期《自然·生物技术》发表一项由美国Arc研究所、格莱斯顿研究所和加州大学旧金山分校科学家合作完成的重要成果:他们将基因工程与表观遗传工程结合,研发出一种新型表观遗传编辑平台,能同时修改人类T细胞中多个基因,实现了对T细胞的高效、安全多基因调控,为突破下一代细胞疗法瓶颈提供了解决方案。
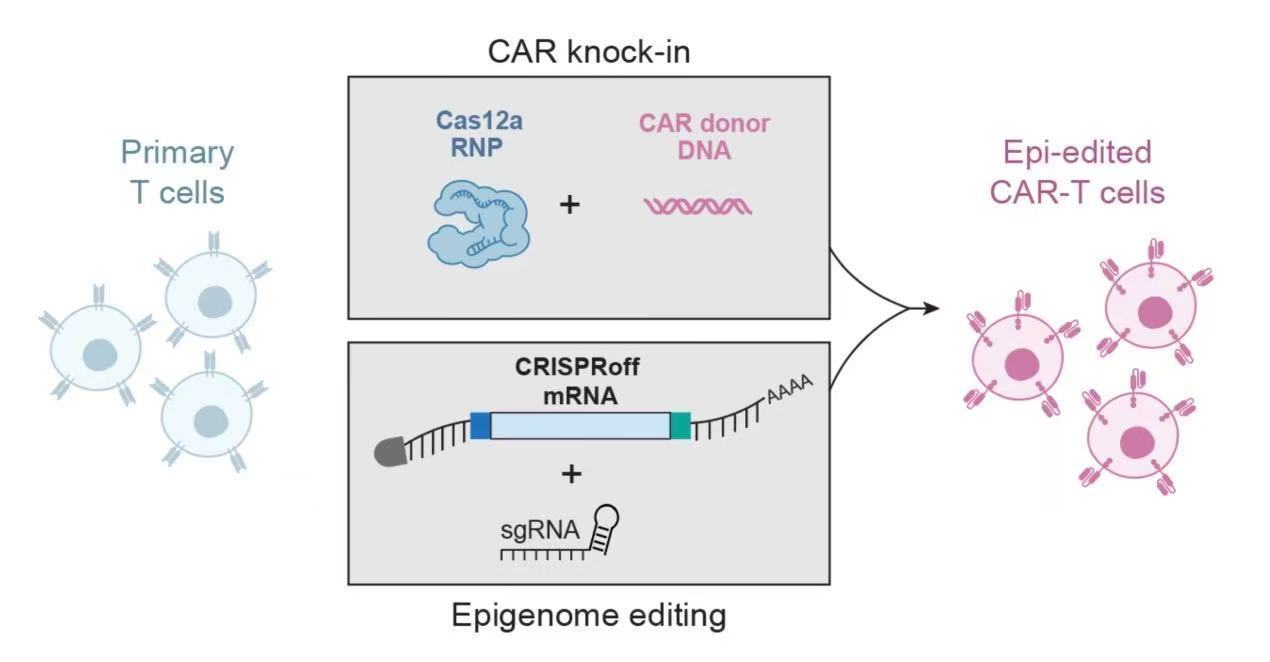
为应对这一挑战,研究人员试图利用CRISPR等基因编辑技术,构建功能更强的“装甲”T细胞,但传统方法在同时编辑多个基因时,常因DNA双链断裂引发细胞毒性,导致大量T细胞死亡,严重限制了可扩展性和临床应用。
此次开发的新平台基于CRISPRoff和CRISPRon技术,巧妙避开了这一难题。与传统基因编辑不同,这两种工具不切割DNA,而是通过表观遗传修饰,在基因启动子区域添加或去除甲基化标记,从而可逆地关闭或激活目标基因。这种方式既避免了基因组损伤,又能实现稳定的基因表达调控。
实验表明,该平台可同时修饰多达5个基因,且T细胞存活率显著高于传统方法。研究人员介绍说:“只需短暂引入表观遗传编辑器,T细胞就能‘记住’这些指令。即使经过多次分裂和反复免疫刺激,基因沉默效果依然稳定维持。”他们利用这一平台构建了增强型CAR-T细胞,一方面通过基因工程插入靶向癌细胞的受体,另一方面使用CRISPRoff沉默RASA2基因(一种抑制T细胞活性的“分子制动器”)。
在实验室中,这些经过双重改造的T细胞展现出更强的持久性和抗肿瘤能力,在多次攻击癌细胞后仍未衰竭;而未沉默RASA2基因的标准CAR-T细胞则迅速失去功能。在小鼠白血病模型中,增强型CAR-T细胞显著提升了肿瘤控制效果和动物生存率。这种方法不仅提升了T细胞的功能,还具备系统性重编程的潜力,有望以可扩展的方式生产更高效的治疗产品。
目前,研究人员正积极规划后续的人体试验,相信这项技术将推动下一代CAR-T疗法的发展,特别是在攻克实体瘤方面,将为更多患者带来希望。
总编辑圈点
虽然CAR-T疗法在血癌治疗中效果显著,但它对付实体瘤依然力不从心。T细胞进入实体瘤微环境后容易力竭,需装备更加有力的武器才能对实体瘤展开持续攻击。此次,科研人员改良了基因剪刀技术,不进行基因剪切,而是给目标基因进行标记,给它们装上开关,让其能够根据需要打开和关闭,从而制造出更加强大的“装甲”T细胞。实验证明,当关上抑制T细胞活性的基因后,增强版T细胞可以“大杀四方”。这项技术为实体瘤的细胞疗法打开了新的大门。




 网友评论
网友评论














