科技日报记者 刘霞
人体强大的免疫系统需要精准调控,否则便可能会攻击我们自身的器官。美国系统生物学研究所的玛丽·布伦科、索诺玛生物治疗公司的弗瑞德·拉姆斯德尔,以及日本大阪大学的坂口志文,因在“外周免疫耐受”机制方面的突破性发现,共同荣获2025年诺贝尔生理学或医学奖。他们的研究揭示了免疫系统如何避免攻击自身组织,守护人体健康的深层奥秘。
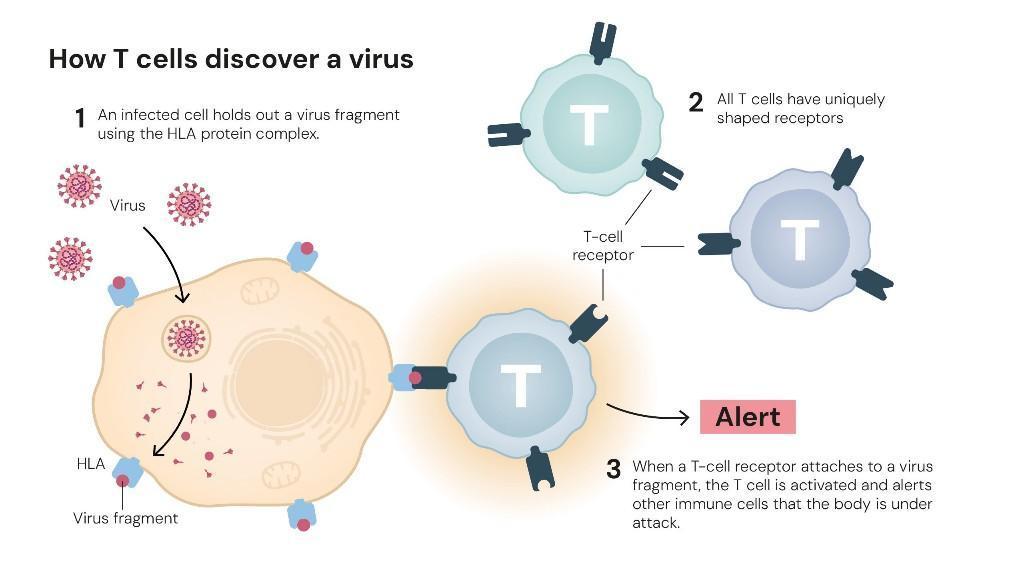
每一天,我们的身体都面临成千上万微生物的侵袭,而免疫系统正是抵御这些入侵的忠诚卫士。然而,有些病原体外形多变,甚至能伪装成人体细胞的“模样”,以躲避免疫系统的攻击。那么,免疫系统如何准确分辨敌我,做到既不放过敌人,也不误伤人体自身组织?
这三位科学家的答案指向了人体内的“调解员”——调节性T细胞。它能够抑制过度活跃的免疫反应,防止免疫细胞攻击自身组织。

“他们的发现彻底改变了我们对免疫系统运作机制的理解,解释了为何大多数人不会患上严重的自身免疫疾病。”诺贝尔奖委员会主席欧莱·卡珀如此评价。
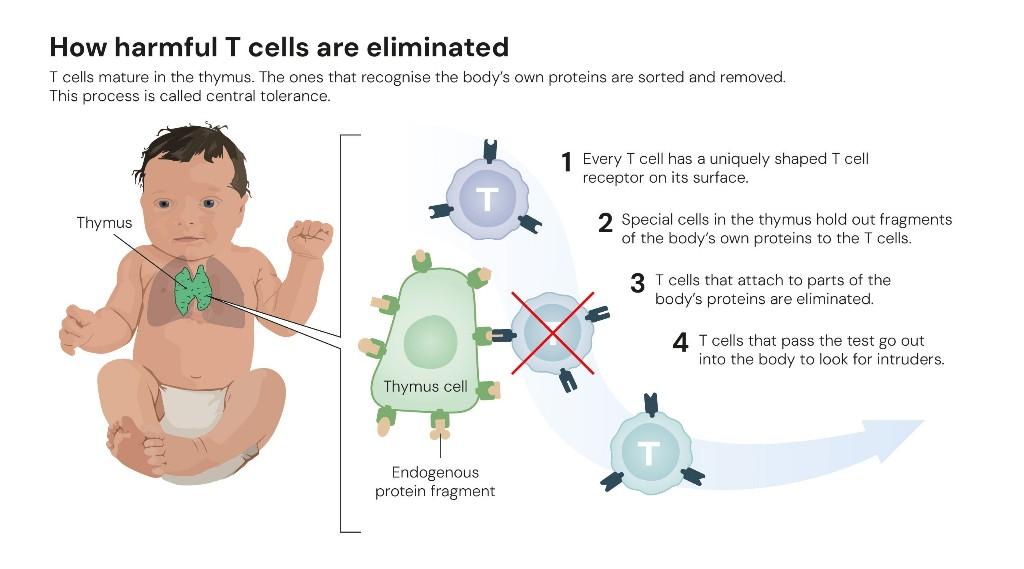
1995年,坂口志文的研究向学界共识发起了挑战。当时,科学界普遍认为,免疫耐受主要依赖“中枢耐受”过程清除胸腺内可能攻击自身组织的免疫细胞。然而,坂口志文发现,即便经过中枢耐受过程,仍有一部分具有潜在攻击性的T细胞会进入外周组织。
他首次识别出一个具有免疫抑制功能的T细胞亚群——调节性T细胞。它们能监测其他免疫细胞,确保免疫系统耐受自身组织,从而防御自身免疫疾病的发生。这一发现为“外周免疫耐受”理论奠定了基础。
时间来到2001年,布伦科与拉姆斯德尔在研究一种易发多器官自身免疫疾病的小鼠模型时,发现其病因源于关键基因FOXP3的突变。进一步的研究显示,人体内该基因的突变会导致一种罕见而致命的遗传性自身免疫疾病,即免疫失调、多内分泌腺病、肠病伴X染色体连锁综合征。该疾病由FOXP3基因突变引起,造成调节性T细胞功能缺陷,进而引发严重的自身免疫反应,累及肠道、内分泌腺和皮肤等多个器官。
两年后,坂口志文将这两项重要发现联系起来,证明FOXP3是调节性T细胞发育与功能的主控基因。缺乏FOXP3的小鼠无法产生功能性调节性T细胞,并迅速出现全身性自身免疫反应。这一关联性研究不仅确立了调节性T细胞的分子基础,也标志着该领域进入功能与机制系统解析阶段。
如今,调节性T细胞已被公认为免疫稳态的核心调控者。它们如同体内的“巡逻队”,持续监控其他免疫细胞的活性,确保免疫反应精准而适度,避免误伤正常组织。

三位获奖者的研究不仅开创了“外周免疫耐受”这一重要领域,也推动了癌症与自身免疫疾病的治疗进展。基于调节性T细胞的疗法正被积极探索,用于治疗1型糖尿病、类风湿关节炎等自身免疫病,也有望催生更成功的器官移植手术。
从基础科学到临床转化,布伦科、拉姆斯德尔和坂口志文的研究,逐步精准揭开了人体在防御外敌与维护自我健康之间保持精妙平衡的奥秘,为呵护人类健康,书写下重要篇章。
(图片来源:诺贝尔奖官网)




 网友评论
网友评论