科技日报记者 刘园园
记者1月7日从西湖大学获悉,该校生命科学学院曹龙兴实验室和医学院解明岐实验室合作,从头设计出一系列能够控制蛋白质“组队”的“遥控器”——可被小分子药物精准调控的蛋白质多聚化系统。这意味着,科学家可以像按下“开关”一样,精准操控蛋白质的“聚”与“散”。
2021年,曹龙兴团队跳出静态蛋白质设计的传统框架,开启动态调控蛋白的研发新方向。“我们想用各种方法让蛋白质‘动起来’,‘响应’光、离子、小分子等外界刺激,设计出具有动态响应能力的蛋白质‘开关’。”曹龙兴说。

在自然界中,可被小分子调控聚散的天然蛋白质种类极少。传统人工改造的蛋白质“组队”系统存在形态有限、小分子毒性大或代谢快等缺陷。
研究团队首先筛选出安全无毒、结构对称的口服抗病毒药物金刚烷胺作为调控信号分子。随后,他们开发出全新的蛋白质设计工具包,并借助西湖大学超算集群完成大规模计算设计。
经过反复优化,研究团队成功研发出“双金刚烷胺诱导三聚体”蛋白dAIT17,其结构与设计模型高度吻合,在药物诱导下可形成稳定三聚体。在此基础上,团队进一步优化得到更灵敏的蛋白dAIT17s,并创新开发出异源二聚体系统和异源三聚体——也就是让两个或者三个不同的蛋白“组队”,实现不同类型蛋白质的精准组队调控。
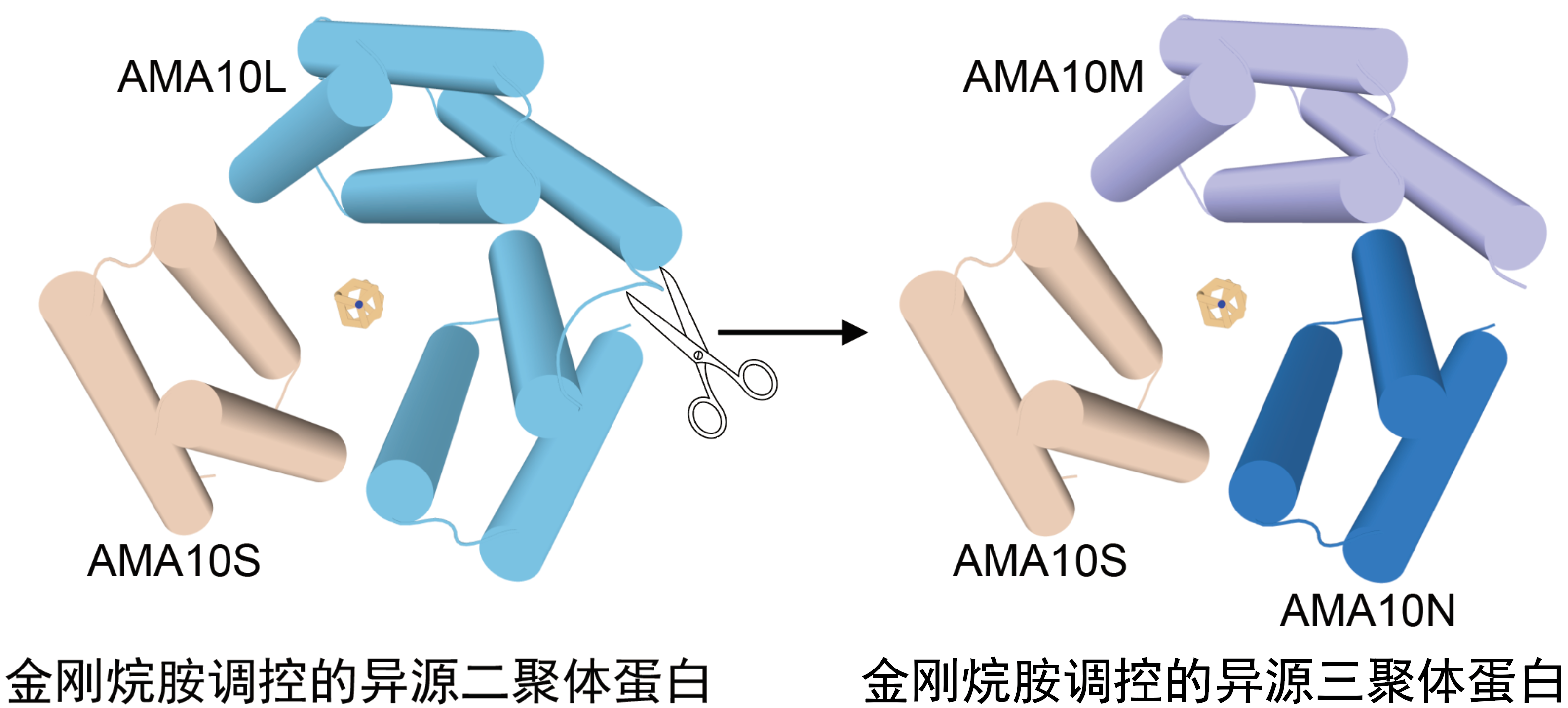
在细胞与动物实验中,这些金刚烷胺响应多聚体系统表现出优异的调控性能,不仅能搭建“基因开关”实现目标基因的精准激活与沉默,还可调控蛋白质在细胞内的定位,甚至诱导蛋白质凝聚体形成。在小鼠实验中,研究人员通过静脉注射携带相关系统的质粒,口服金刚烷胺即可激活肝脏中的报告基因,验证了该系统在体内的安全性与有效性。
“目前,小鼠体内能工作的、符合临床与安全标准的‘基因开关’,其实很少。”解明岐表示,这款新型“基因开关”安全、可控、便捷,前景可期。
据介绍,未来,这项研究成果有望为基因治疗、智能细胞疗法、肿瘤精准干预、可编程疫苗和合成生物系统等应用领域提供安全、灵活的蛋白质新工具,迈向“编程生命”新时代。
(西湖大学供图)




 网友评论
网友评论















