科技日报记者 罗云鹏 通讯员 赵梓杉
对炎症性肠病患者而言,反复腹痛、腹泻和便血,往往意味着肠黏膜在破损与修复之间长期拉锯。然而,肠道环境复杂,传统止血剂或黏膜修复药物多为“静态材料”,很难在体内稳定黏附;病灶定位往往依赖影像学或侵入性操作配合。是否有一种治疗材料,能在进入体内后自动识别病灶、黏附,并针对局部持续发挥治疗作用?
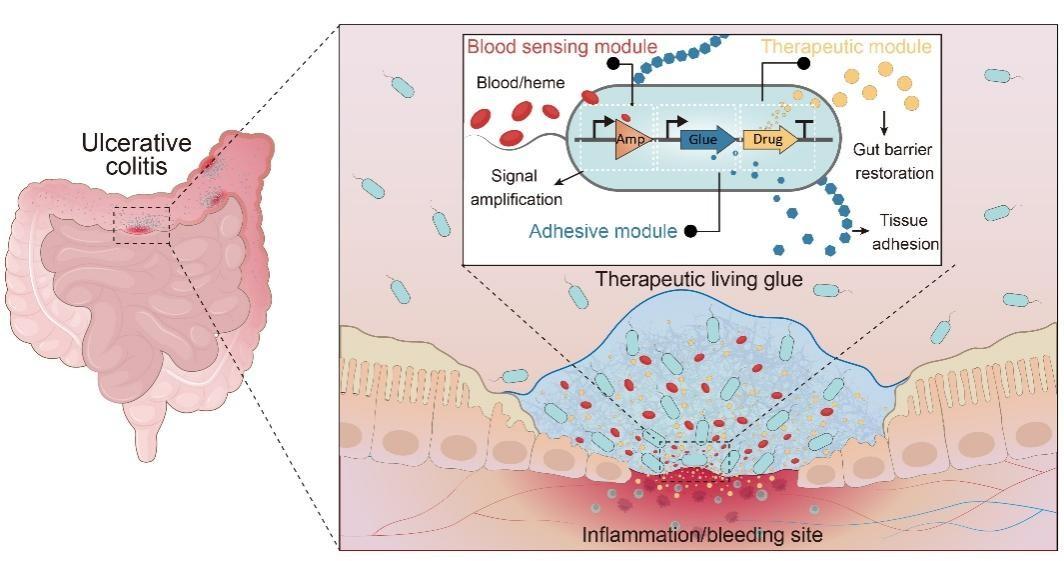
1月19日,中国科学院深圳先进技术研究院定量合成生物学全国重点实验室、合成生物学研究所研究员钟超团队联合深圳大学医学部教授黄鹏团队在《自然·生物技术》发表研究,提出一种面向炎症性肠病的“智能活胶水”。该体系以工程化肠道细菌为载体,能够感知肠道出血信号,在病灶处原位形成兼具黏附与治疗功能的生物胶基质,实现“感知—定位—治疗”一体化干预,为炎症性肠病精准治疗提供了新的合成生物工程思路。
病灶自己“发信号”
这一研究的切入点并非某种全新的外源刺激,而是疾病本身所释放的信号。对炎症性肠病而言,出血不仅是常见症状,更是病灶位置最直接可靠的标志。
研究团队由此提出一个关键设想:能否让治疗系统直接响应出血信号,在真正需要的地方启动,而不是在整个肠道“平均用力”?
这一思路源于团队对自然界黏附策略的长期研究。在对贻贝、藤壶等海洋生物黏附机制的系统分析中发现,这些生物能够感知环境变化,并按需释放黏附蛋白,从而实现快速而稳定地附着。
受“可感知—可响应”的动态黏附策略启发,研究团队曾探索了多种刺激响应型“活胶水”体系,但仍高度依赖外部刺激,距离真实疾病应用场景尚有差距。2021年,团队将研究重心转向疾病信号本身,并最终将炎症性肠病及其典型特征——肠道出血——引入研究视野。
在病灶处“成胶”
在本项研究中,团队选用人体肠道常驻微生物大肠杆菌作为工程化载体。当工程菌检测到血液相关信号后,便启动预先设计的反应:一方面在出血位置原位形成黏附基质,另一方面同步释放修复因子,在局部持续发挥作用。
文章共同通讯作者安柏霖博士表示,在研发过程中,血液响应基因线路在驱动黏附或治疗蛋白等高负载输出时,整体表达水平不足,难以满足体内应用需求。围绕这一瓶颈,研究团队通过逐级转录放大策略系统优化关键调控参数,使工程菌对血液信号的响应强度提升至百倍以上,同时避免在无出血条件下被误激活,为活胶水在体内实现精准感知与稳定功能输出奠定了基础。
在黏附层面,工程菌在被激活后会分泌来源于海洋藤壶的水泥蛋白,在水环境中自组装形成稳定黏附基质。
实验结果显示,活胶水可在出血位置原位形成致密保护层,显著提升抗压与防漏功能,使其在湿润、蠕动的肠道环境中仍能稳定停留。同时,研究团队在黏附体系中进一步引入黏膜修复肽,使活胶水在“封堵”的同时持续释放修复信号,促进受损黏膜恢复,针对炎症性肠病黏膜屏障受损这一关键病理环节实现协同干预。
多模型验证疗效
在葡聚糖硫酸钠(DSS)诱导的急性结肠炎小鼠模型中,“智能活胶水”可显著改善动物整体病情。基于光声/超声成像结果显示,“智能活胶水”处理后肠道内与出血相关的信号明显降低。
组织与免疫层面的观察进一步表明,“智能活胶水”不仅在出血处形成物理保护层,还能促进肠黏膜修复、增强屏障功能并抑制局部炎症反应,从而在病灶处实现“止血、修复并抗炎”的协同作用。该体系在遗传性结肠炎等慢性病模型中同样保持稳定疗效,显示出对慢性病程的干预价值。
此外,研究团队还探索了口服递送方案,通过肠溶包裹实现肠道释放,使其在炎症肠道中被特异激活、在健康宿主中更快清除,为安全性与临床可达性提供线索;同时同步评估免疫相容性并引入多重生物安全策略。
通讯作者钟超表示,这项工作提出了一种由疾病信号直接驱动的活体治疗材料新范式,使治疗系统能够在体内自主识别病灶、原位发挥作用,而不再依赖外部定位或持续干预。“我们希望让治疗材料像生物系统本身一样,能够‘看懂’疾病信号,并在正确的时机和位置发挥功能。”
下一步,团队将围绕机制解析和安全性评估持续推进,并在更接近临床条件的模型中开展验证。同时,这一“感知—定位—治疗”的设计思路,也有望推广至其他慢性疾病或局部损伤场景,为工程化活体材料走向临床应用提供新路径。




 网友评论
网友评论















