科技日报记者 刘园园
记者2月5日从西湖大学获悉,该校生命科学学院特聘研究员蔡尚团队首次揭示,瘤内菌具有通过差异化定位调控肿瘤免疫的双重作用,其为防治肿瘤复发提供了全新视角。这是该团队继2022年首次证实乳腺癌胞内菌促肿瘤转移后,在肿瘤菌群研究领域的又一重要进展。相关研究日前刊发在《细胞》期刊。
“根据免疫系统的应答情况,肿瘤可分为免疫激活型的‘热肿瘤’与免疫抑制型的‘冷肿瘤’。”蔡尚介绍,在“热肿瘤”的微环境中,免疫细胞“积极作战”,患者对免疫治疗敏感,患者预后更好;在“冷肿瘤”的微环境中,免疫系统“消极抵抗”,免疫应答受抑制,患者对免疫治疗不敏感。近年来,肿瘤内存在细菌的发现为相关研究带来新视角,但细菌在肿瘤内的分布位置是否影响免疫反应,其具体机制尚不明确。
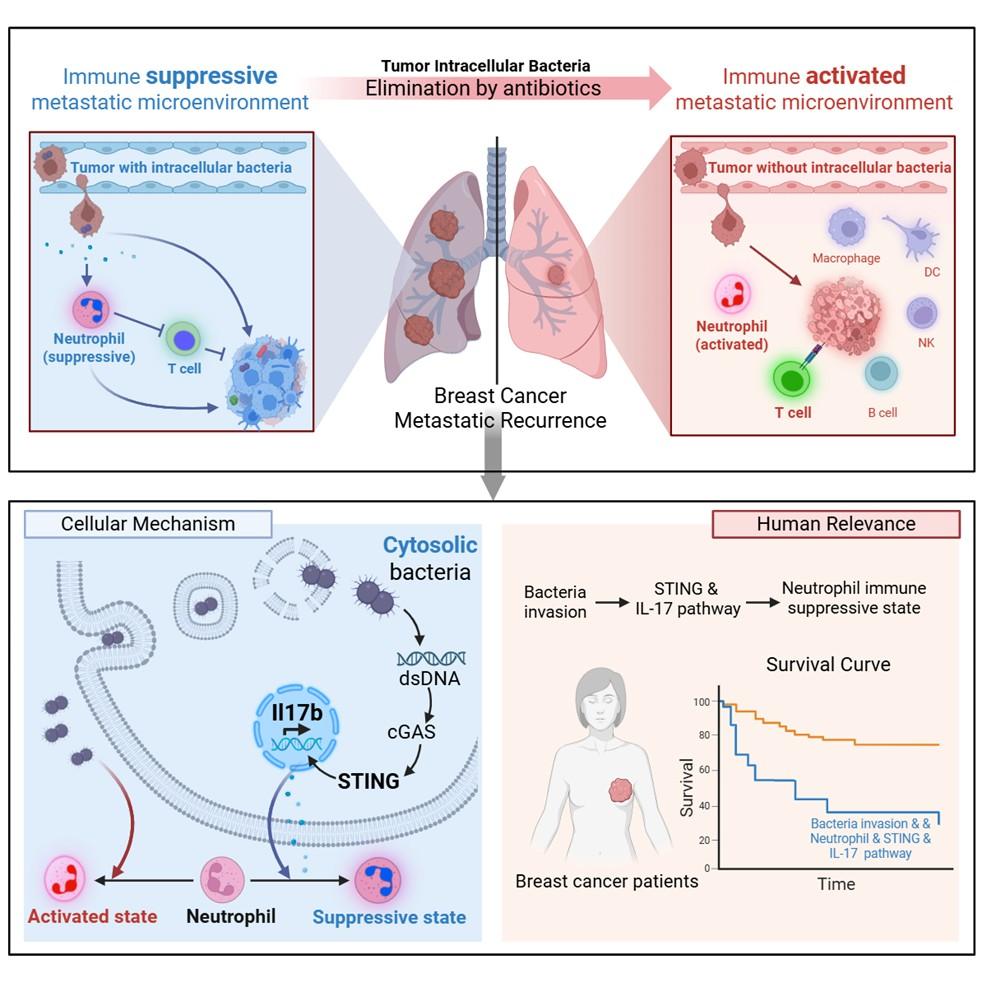
为破解这一谜题,研究团队首先构建严格的胞内菌研究模型,通过特异清除胞外菌的抗生素,建立体外类器官-细菌共培养系统,排除胞外菌干扰。随后的两组关键小鼠实验证实,胞内菌是肿瘤复发的关键推手:胞内菌存在时,乳腺癌肺部复发率达65%,而清除胞内菌后复发率降至6.7%;临床前术后复发模型中,细菌入侵信号强的小鼠肿瘤复发率高达80%,清除胞内菌后降至20%。更重要的是,在无免疫系统的小鼠中,这一促复发效应消失,表明细菌通过操控免疫系统间接影响肿瘤复发。
进一步研究发现,胞内菌与胞外菌对免疫的调控作用截然不同:两者均会诱导中性粒细胞富集,但胞内菌将其“策反”为免疫抑制型细胞,胞外菌则使其成为“抗癌战士”。从具体调控机制来看,活的胞内菌会激活肿瘤细胞的特定信号通路,诱导肿瘤细胞分泌IL-17B,这一“策反信号”使中性粒细胞进入抑制状态,抑制T细胞功能,促进肿瘤复发;而胞外菌无法激活该信号通路,直接诱导中性粒细胞抗肿瘤。
“这项研究表明,瘤内菌并非简单的‘伴随菌群’,而是影响肿瘤进展的关键生物学因素,这为肿瘤治疗提供了新的思路。”蔡尚表示,未来或许可以通过调控瘤内菌的生长位置和作用方式,来调控人体对肿瘤细胞的免疫应答。




 网友评论
网友评论















