科技日报记者 俞慧友
造血干细胞如何在压力中“保全群体质量”有了新发现。6月26日,记者从湖南大学获悉,该校生命医学交叉研究院教授刘禄团队联合密歇根大学教授李清团队,揭示了一种新的人体干细胞“保全”机制:在蛋白质稳态受损的压力下,人体造血干细胞可通过启动增殖和分化程序来“保全”干细胞群体的质量,而非传统观点中认为的“促进细胞死亡”。这一发现,有望为血液疾病防治提供新的干预策略。相关成果日前在线发表于国际血液学权威期刊《血液》上。
造血干细胞是产生血液的源头细胞,支撑着人体一生中的血液更新。因此,造血干细胞群体既需要不断补充新生力量,同时又需要及时清除受损、衰老的细胞个体,来维持造血干细胞群体的健康平衡。不过,多种生理或病理条件下,造血干细胞中的蛋白质处理过程都容易被破坏。这种破坏会削弱造血干细胞的正常功能,并引发血液系统异常和疾病,甚至加速整个机体的衰老。
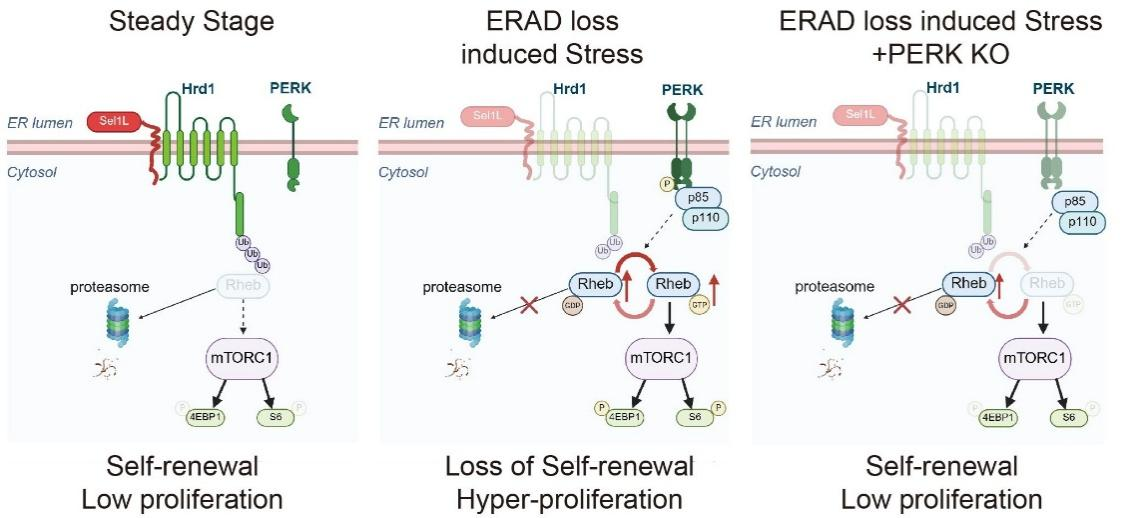
此前,科学界普遍认为感知蛋白质加工和处理的“传感器”——蛋白激酶 R (PKR) 样内质网激酶(以下简称“PERK”)主要通过诱导细胞凋亡(一种受程序控制的细胞死亡方式)来剔除损伤的细胞,但对PERK在造血干细胞中的其他作用并不清楚。
刘禄团队与李清团队合作建立了一种模拟体内“温和压力”的动物模型,可精确模拟蛋白质处理系统功能受损时造血干细胞所面临的真实环境。研究发现,在这种“温和压力”条件下,细胞中蛋白质处理系统出现障碍时,PERK不是简单地启动受损细胞的“自毁”程序,而是激活了一条促进细胞增殖和分化的信号通路,让那些因为蛋白质处理系统障碍的造血干细胞个体以“增殖和分化”的方式从造血干细胞群体中被清除。此外,团队通过研究进一步证明了这种调控作用依赖PERK的激酶活性,这与科研界普遍公认的“自毁”程序大不相同。
这一研究发现不仅有助于深入认知造血干细胞如何在压力条件下实现自我调节,还可能为进一步揭示白血病早期发生过程中干细胞“保全”机制的破坏提供新视角。
刘禄称,下一步团队将进一步探索PERK驱动的这种“非典型”的干细胞群体的“群体质量保全”机制在多种血液疾病及衰老相关病理状态中的作用,力争为血液疾病防治提供新的干预策略。
(受访者供图)