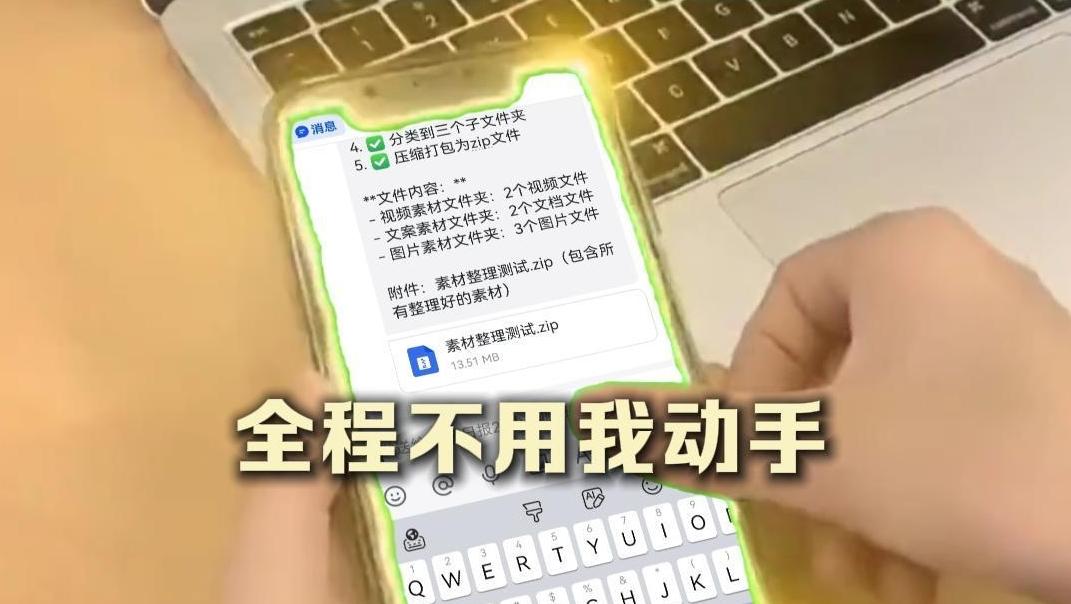
科技日报记者 张佳欣
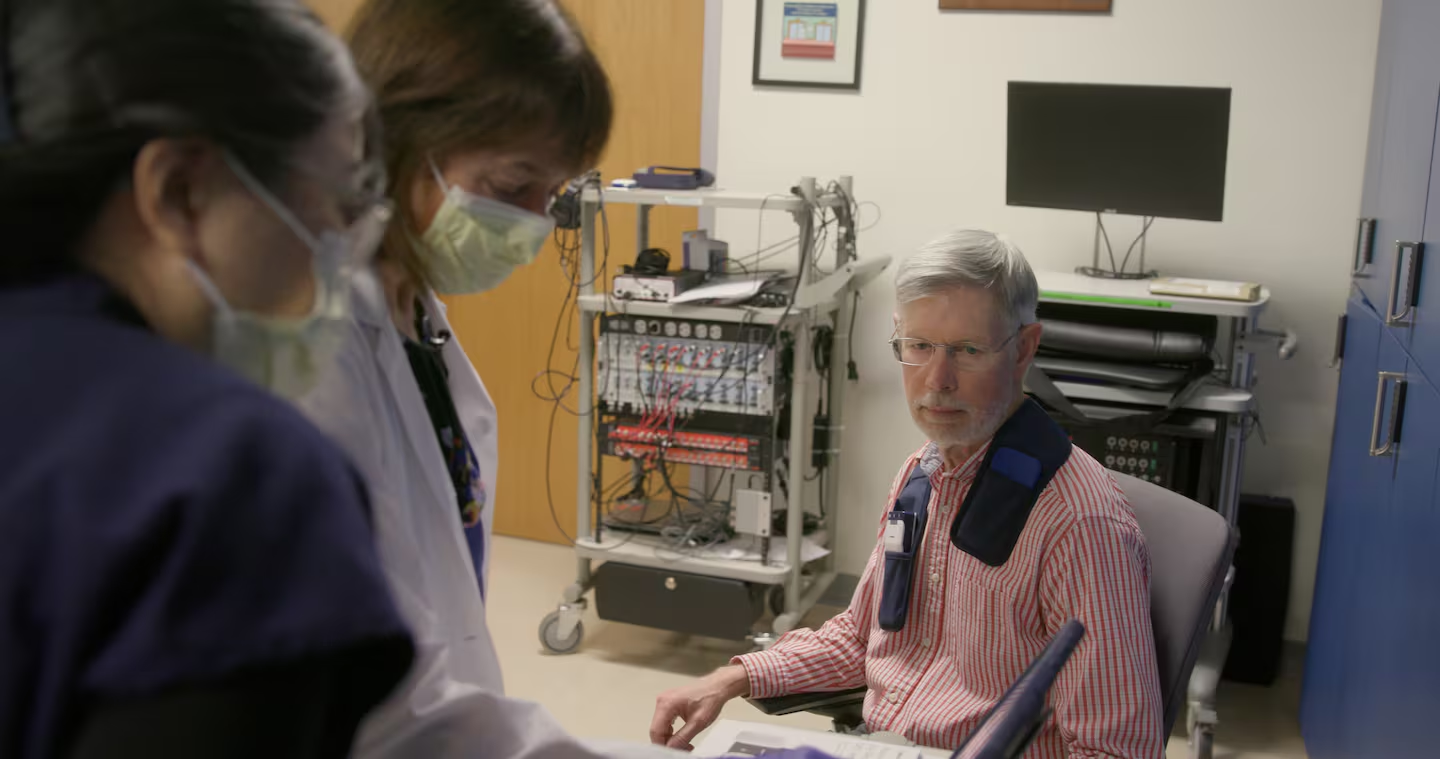
美国斯坦福大学商学院名誉教授凯斯·克雷比尔在与帕金森病抗争近25年后,终于在2020年决定尝试植入一种可能缓解症状的脑部装置。起初,他对这种“脑深部刺激”(DBS)手术心存疑虑,但一项新技术的出现打消了他的顾虑。
这是一种名为“自适应脑深部刺激”(aDBS)的升级版装置,其不再持续不断地释放电脉冲,而是能“倾听”病人的脑电波,并据此自动调整刺激强度,犹如一个智能节拍器。克雷比尔成为临床试验的首位志愿者。如今,5年过去,他仍坚定选择继续使用它。“我感觉好多了,不再纠结其原理。”
英国《自然》杂志报道称,这项技术已获得美国和欧洲监管机构批准,或将重塑帕金森病以及其他脑疾病的治疗格局。
刺激从“恒定放电”走向“按需调节”
帕金森病是一种常见的神经退行性疾病。患者在大脑深处的基底节区域,存在一种异常的脑电活动,尤其在β波(13—30赫兹)频段上频繁出现。β波强度是反映运动状态的重要标志,当症状加重时,β波往往更加剧烈,而药物或脑刺激疗法可有效压制这种异常节律。
目前主要的治疗手段是服用提升多巴胺水平的药物,但这种方法难以模拟大脑持续释放的自然节奏,容易导致症状波动。比如,病人可能在早晨服药后出现不自主动作,到了傍晚药效减退又变得僵硬,副作用也因人而异。
当症状难以控制时,神经科医生会建议进行DBS手术。这种装置全天候向大脑特定区域发送电脉冲,以抑制异常信号。自上世纪90年代末在欧美获批以来,已有超过20万人接受了DBS手术。然而,传统DBS采用“持续刺激”模式,缺乏对病情波动的响应能力,往往需要医生频繁调整参数,这可能加重副作用。
aDBS正是在这一背景下出现的突破性技术。它并非持续放电,而是通过内置传感器和人工智能算法,实时读取患者大脑中的β波活动,判断是否需要调整刺激强度。当脑电活动显示运动障碍将要加重时,设备会自动加强刺激;而当药效正在发挥作用、脑电波恢复正常时,则自动减弱电流输出,避免治疗过度。
自适应技术从理论走向人体试验
自适应技术真正进入人体试验是近几年的事。由斯坦福大学神经学家海伦·布朗特—斯图尔特牵头的一项临床试验于2020年启动,共招募68位中晚期帕金森病患者参与研究。克雷比尔是其中首位受试者。
研究团队通过软件“解锁”已有设备中的自适应功能,使患者从传统模式无缝切换至aDBS。5年跟踪数据显示,大部分患者在刺激强度更低的情况下获得了更理想的运动控制效果,同时药物摄入量减少,副作用也随之下降。
据美国《华盛顿邮报》报道称,一项尚未正式发表的报告显示,98%的参与者选择在长期随访中继续使用aDBS。
更值得关注的是,aDBS在一些传统DBS难以改善的症状上也展现出潜力。去年一项研究还表明,它有助于减轻“冻结步态”。其他研究表明,aDBS还能减少说话含糊等语言障碍。
应用从帕金森病走向更广泛神经疾病
如果特定的脑电波异常是疾病的“节奏信号”,它会只局限于帕金森病吗?
科学家们正试图在不同病症中寻找相应的“神经指纹”,以将自适应刺激原理推广至更广人群。例如在妥瑞氏症研究中,荷兰团队发现抽动发作前存在异常脑电信号;在强迫症试验中,阿姆斯特丹大学的一项研究初步锁定了与强迫行为相关的脑区活动信号。这意味着未来可能实现对强迫症发作的提前干预,而非被动抑制。此外,在难治型抑郁症研究中,研究人员也看到了aDBS的潜力。一些研究人员甚至认为,DBS正在逐步向“脑机接口”演进。
当然,要让这一图景真正落地,还有不少现实阻力。随着设备复杂度增加,医生在使用时需要设定和调整的参数也随之增多。同时,大规模临床试验面临高昂成本。据悉,每名患者花费可能超过100万美元。
但不可否认的是,aDBS已经提供了一种可验证、可推广的神经疾病治疗新路径。从帕金森病的运动控制,到未来精神健康的脑波干预,它所指向的,是一个“读懂大脑语言”的全新医学时代。